El pasado viernes el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) rechazó autorizar la comercialización en Europa del fármaco Leqembi (nombre comercial del lecanemab), destinado al tratamiento del alzhéimer. Se trata de una decisión controvertida, que en los últimos días ha generado una cascada de opiniones. Y que a buen seguro seguirá dando que hablar en los próximos meses.
En España la última en posicionarse sobre el tema ha sido la Confederación Española de Alzheimer y otras Demencias (CEAFA). Desde esta organización consideran que los ensayos clínicos recientes de lecanemab y otros medicamentos antiamiloides habían marcado "un punto de inflexión". Por eso explican que están "profundamente decepcionados" por el hecho de que las personas con enfermedad de Alzheimer en Europa "estén ahora excluidas del acceso al lecanemab". Aunque se muestran optimistas con la posibilidad de que los reguladores de la UE reconsideren su postura.
"Entendemos que lecanemab no es un medicamento milagroso para todas las personas con enfermedad de Alzheimer. Sin embargo, la existencia de un primer fármaco modificador de la enfermedad, con un novedoso modo de acción, constituye un avance innegable e importante para un campo que lleva más de dos décadas esperando nuevos medicamentos. Lecanemab ha demostrado efectos sobre la progresión de la enfermedad, así como sobre los criterios de valoración secundarios, como la calidad de vida y la carga del cuidador. En lugar de excluir a todos los pacientes de este nuevo tratamiento por motivos de seguridad, habríamos esperado que la Agencia Europea de Medicamentos autorizara el medicamento con un plan claro de gestión de riesgos para abordar los posibles efectos secundarios", deslizaron desde CEAFA en un comunicado publicado este lunes.
En la actualidad 6,9 millones de personas sufren alzhéimer en Europa. Y se estima que, debido al envejecimiento poblacional, esa cifra se duplique de aquí al año 2050. Por eso hay prisa para encontrar un tratamiento efectivo contra una de las enfermedades más crueles que existe. Estados Unidos, Japón, China, Corea del Sur, Hong Kong e Israel ya han dado el paso aprobando el lecanemab a lo largo del último año. Suiza y el Reino Unido están estudiando hacer lo mismo. Pero Europa lo ha rechazado.
Diferencia de criterios entre la UE y EE.UU
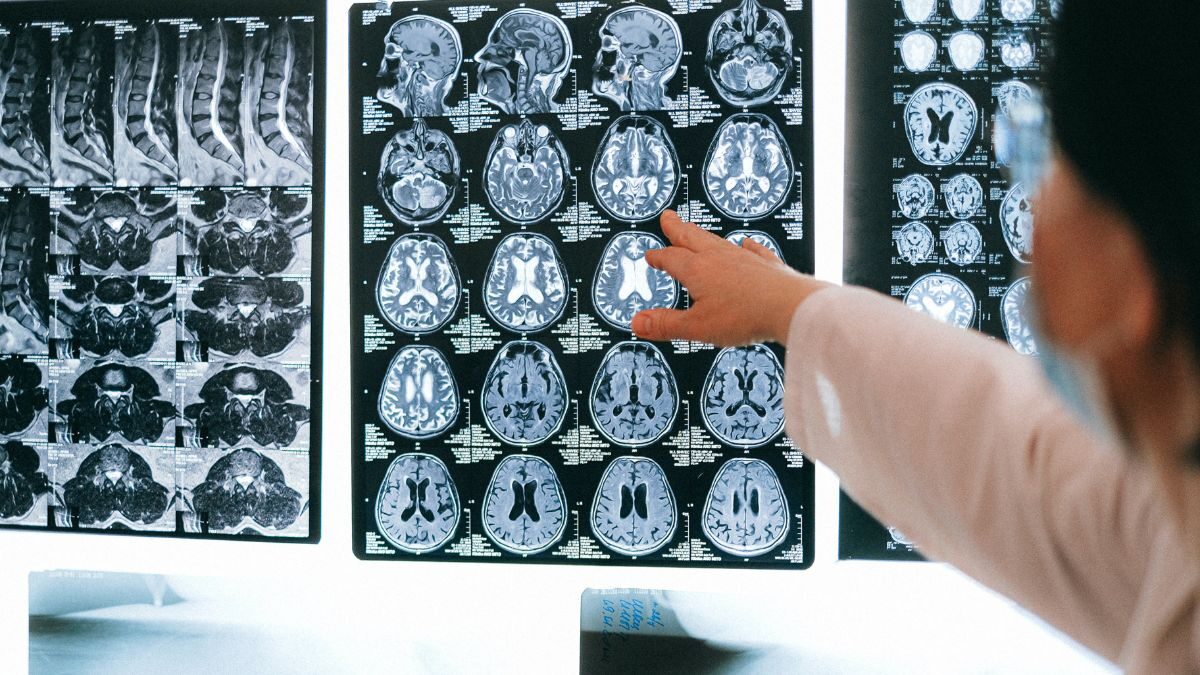
Leqembi fue desarrollado como un medicamento para el tratamiento de adultos con deterioro cognitivo leve (problemas de memoria y pensamiento) debido a la enfermedad de Alzheimer y la enfermedad de Alzheimer en etapa temprana. Debe administrarse mediante infusión (goteo) en una vena una vez cada dos semanas.
El medicamento contiene el principio activo lecanemab, un anticuerpo monoclonal (un tipo de proteína) que se adhiere a una sustancia llamada beta amiloide, que forma placas en el cerebro de las personas con enfermedad de Alzheimer. Al unirse a la beta amiloide, el fármaco reduce las placas amiloides en el cerebro y, por lo tanto, se esperaba que retrasara el empeoramiento de la enfermedad.
De acuerdo con la EMA, Biogen y Eisai (las dos farmacéuticas detrás de este fármaco) presentaron los resultados de un estudio principal en el que participaron 1.795 personas con enfermedad de Alzheimer en etapa temprana que tenían placas de beta amiloide en el cerebro y que recibieron Leqembi o placebo (un tratamiento ficticio). La principal medida de la eficacia fue un cambio en los síntomas después de 18 meses, medido mediante una escala de calificación de demencia conocida como CDR-SB. La escala CDR-SB se utiliza para evaluar la gravedad de la enfermedad de Alzheimer en los pacientes. Incluye preguntas que ayudan a determinar en qué medida la vida diaria del paciente se ha visto afectada por el deterioro cognitivo. La escala va de 0 a 18, y las puntuaciones más altas indican un mayor deterioro.
El estudio principal mostró que después de 18 meses de tratamiento, la puntuación CDR-SB en los pacientes tratados con Leqembi aumentó en 1,21 en comparación con 1,66 en los que recibieron placebo. Aunque los pacientes que recibieron Leqembi tuvieron puntuaciones CDR-SB más bajas que los que recibieron placebo, la diferencia entre los dos grupos fue pequeña.
"La preocupación de seguridad más importante con Leqembi es la aparición frecuente de anomalías en la imagen relacionadas con amiloide (ARIA), un efecto secundario observado en las imágenes cerebrales que implica hinchazón y posibles hemorragias en el cerebro. Aunque la mayoría de los casos de ARIA en el estudio principal no fueron graves y no implicaron síntomas, algunos pacientes sufrieron eventos graves, incluidas hemorragias importantes en el cerebro que requirieron hospitalización. La gravedad de este efecto secundario debe considerarse en el contexto del pequeño efecto observado con el medicamento", explicaron desde la agencia europea.
Además, al CHMP le preocupaba el hecho de que el riesgo de ARIA es más pronunciado en personas que tienen una determinada forma del gen de la proteína apolipoproteína E, denominada ApoE4. El riesgo es mayor en personas con 2 copias del gen ApoE4 , que se sabe que corren el riesgo de desarrollar la enfermedad de Alzheimer y, por lo tanto, es probable que sean aptas para el tratamiento con Leqembi.
En definitiva, lo que sucedió es que la EMA consideró que los beneficios del tratamiento no son lo suficientemente importantes como para compensar los riesgos asociados a Leqembi, por lo que recomendó denegar la autorización de comercialización en la UE. Una decisión que tomaron, según detallaron, después de consultar a un grupo asesor científico sobre neurología, que incluía expertos y personas que conviven con la enfermedad.
Decepción entre los expertos
Desde SMC España se han puesto en contacto con expertos de distintos perfiles para preguntarles su opinión sobre este asunto. Y aunque hay matices en sus posturas, la tendencia general es la preocupación y la decepción por la postura de Europa.
"La decisión de la EMA conlleva dos grandes preocupaciones, tanto para la comunidad clínica, médica y asistencial, como para la investigadora. Los pacientes de Europa estarán discriminados, no tendrán las mismas oportunidades que los pacientes de otros países. Y a nivel de investigación y de inversión en investigación, Europa también quedará en segundo lugar. Volveremos a pasar el desierto. Estaremos en plena sequía otra vez", comentó Mercè Boada Rovira, neuróloga y directora médica de Ace Alzheimer Center Barcelona.
"El ensayo clínico de fase III de lecanemab demostró que hace lo que se supone que debe hacer: reduce el amiloide tóxico en el cerebro y ralentiza el deterioro cognitivo. Desde el punto de vista científico, se trataba de un importante paso adelante. Sin embargo, la magnitud del efecto fue modesta, a lo que se sumaron importantes efectos secundarios, como inflamación y hemorragias cerebrales que provocaron la muerte de algunas personas. La decisión de la EMA será una decepción para muchos, pero hay razones para mantener la esperanza. Lecanemab ha demostrado que es posible ralentizar la progresión de la enfermedad y la investigación funciona. Ahora tenemos que redoblar nuestros esfuerzos para descubrir tratamientos nuevos y más seguros", valoró Tara Spires-Jones, presidenta de la Asociación Británica de Neurociencia.
John Hardy, catedrático de Neurociencia y jefe de grupo en el Instituto de Investigación sobre la Demencia del Reino Unido, University College de Londres (UCL), fue más crítico: "Estoy decepcionado por la decisión de no conceder la licencia a lecanemab. La cuestión de si el indudable beneficio estadístico del tratamiento merece la pena frente al riesgo de efectos secundarios graves, aunque poco frecuentes, es siempre difícil con cualquier tratamiento y, en esta ocasión, la EMA en Europa y la FDA en EE.UU han llegado a conclusiones diferentes cuando se les han presentado datos similares. Estoy seguro de que ahora veremos a personas ricas con enfermedad de Alzheimer en fase inicial volar a EE.UU o a otras jurisdicciones para recibir tratamiento. Aunque supongo que esta decisión se revisará a medida que los médicos estadounidenses y otros profesionales recopilen e informen sobre la experiencia real con los tratamientos".
Te puede interesar
-

El "debut temprano" en alzhéimer y los cuidados: "No puedes olvidarte de la persona que era antes"
-

Muere la leyenda del cine estadounidense Gena Rowlands a los 94 años
-

Ernest Maragall anuncia su salida de ERC por la 'guerra de los carteles'
-

Día Mundial de la Salud: su transformación global a lo largo de la última década
Lo más visto
- 1 Un actor de La Promesa se ausenta del rodaje y hace dudar
- 2 Abren una investigación en RTVE por la emisión de 7.291
- 3 El juez Peinado salpica al Ibex-35 por el 'caso Begoña Gómez'
- 4 Los grandes bancos de inversión dan la espalda a los aranceles de Trump
- 5 Avance semanal de La Promesa del lunes 7 al viernes 11 de abril
- 6 Pablo Iglesias: ajuste de cuentas
- 7 Incertidumbre en las bodegas españolas: un importador de EEUU anula un pedido de 600 botellas de vino
- 8 Génova planta al presidente del PP catalán, Alejandro Fernández
- 9 Quién es Peter Navarro, el gurú arancelario de Trump
![La dependencia tecnológica, otra arma de Trump contra la UE: "Si quisieran [...]](https://www.elindependiente.com/wp-content/uploads/2025/04/nube-eeuu-empresas-350x365.jpg)
![Los retos y las oportunidades para MasOrange ante una posible salida a [...]](https://www.elindependiente.com/wp-content/uploads/2025/04/europapress-6462504-fachada-sede-masorange-18-enero-2025-pozuelo-alarcon-madrid-espana-350x365.jpg)
![Digi irrumpe en el fútbol con precios 'lowcost' y estudiará ampliar más [...]](https://www.elindependiente.com/wp-content/uploads/2025/04/europapress-6517283-jugador-real-oviedo-santi-cazorla-atiende-medios-comunicacion-inauguracion-350x365.jpg)
![La guerra de precios de las 'telecos' se recrudece en 2025 con [...]](https://www.elindependiente.com/wp-content/uploads/2024/12/telefonia-350x365.png)
![Nike, un gigante en crisis: su valor cae un 30% en un [...]](https://www.elindependiente.com/wp-content/uploads/2025/03/nike-caida-bolsa-350x365.jpg)
![¿Qué pasó con el 'pajaporte'?: la app antiporno del Gobierno que debía [...]](https://www.elindependiente.com/wp-content/uploads/2025/03/europapress-6065526-ministro-transformacion-digital-funcion-publica-jose-luis-escriva-rueda-350x365.jpg)
![Ventajas y desventajas del Internet por satélite capitaneado por Elon Musk que [...]](https://www.elindependiente.com/wp-content/uploads/2025/03/f4d7vusbmaeq7s5-350x365.png)
![El director financiero de Finetwork abandona la compañía un mes después de [...]](https://www.elindependiente.com/wp-content/uploads/2025/02/europapress-6430646-cartel-tienda-finetwork-enero-2025-madrid-espana-operadora-350x365.jpg)